الروابط الكيميائية
استكمالًا لسلسلة عالم الأحياء، تحدثنا في المقال الساق عن كيمياء الحياة، وتطرقنا لتعريف العناصر والذرات، وسنُكمل في هذا المقال رحلتنا هذه.
تعرفنا على الذرة متناهية الصغر، والتي تتألف من النواة التي تحتوي على البروتونات موجبة الشحنة، والنيوترونات المتعادلة، وتُحيط بالنواة الإلكترونات سالبة الشحنة.
ولكن كيف تتحد هذه الذرات معًا؟
تتحد هذه الذرات معًا عن طريق الروابط الكيميائية، وفي الحقيقة يوجد العديد من الأنواع للروابط الكيميائية، وهذا ما نحن بصدد طرحه.
الإلكترون المكافئ
بالعودة للجدول الدوري، يتضمن الجدول الدوري العديد من المجموعات، وهذه المجموعات تحتل أعمدة محددة في الجدول الدوري، وكل مجموعة تمتلك خصائص متشابهة تقريبًا، وهذا بسبب امتلاكها لنفس قيمة الإلكترون المكافئ.
ولكن ما هو الإلكترون المكافئ؟
هو الإلكترون النشط الذي يُمكنه التفاعل مع الأشياء المختلفة، ولأن عناصر المجموعة الواحدة تحتوي على العدد ذاته من الإلكترونات المكافئة، فهذا يعني أنها تمتلك الأيونات ذاتها.
عمومًا، تترتب الإلكترونات حول النواة بطريقة معينة في مستويات طاقة تنقسم إلى مدارات، وهذه المدارات هي:
- المدار الأول s: والذي يستوعب فقط إلكترونين.
- المدار الثاني p: والذي يستوعب 6 إلكترونات.
- المدار الثالث d: والذي يستوعب 10 إلكترونات.
- المدار الرابع f: والذي يستوعب 14 إلكترون.
وبالاستعانة بهذه المدارات مع الشكل أدناه يُمكننا تحديد ترتيب الإلكترونات في الذرة، وهذا باتباع الأسهم السوداء في الصورة، والقيام بتوزيع العدد الذري لكل عنصر في المدارات.

على سبيل المثال العدد الذري لعنصر الهيدروجين هو 1، وهذا يعني أن توزيعه الإلكتروني هو:
1s1
العدد الذري لعنصر الصوديوم هو 11، وهذا يعني أن توزيعه الإلكتروني هو:
1s2 2s2 2p6 3s1
العدد الذري لعنصر الزنك هو 30، وهذا يعني أن توزيعه الإلكتروني هو:
s2 2s2 2p6 3s23p6 4s2 3d101
عدد الإلكترونات المكافئة هو عدد الإلكترونات في المدار الأخير، ومن الجدير بالذكر أنه لا يجب أن يزداد عن رقم 8، ولذلك فعدد الإلكترونات المكافئة للزنك هو 2، وللصوديوم هو 1، وكذلك للهيدروجين.
مجموعات الجدول الدوري
على أقصى اليمين، نجد مجموعة يُطلق عليها اسم الغازات النبيلة أو الغازات الخاملة، وهي الغازات الأكثر استقرارًا، وهذا لأن المدارات الأخيرة فيها ممتلئة تمامًا، ولا يُمكنها اكتساب أو خسارة الإلكترونات لأنها مستقرة تمامًا.
على يسار الغازات النبيلة في الجدول الدوري، نجد مجموعة من العناصر يُطلق عليها اسم الهالوجينات، وعدد الإلكترونات المتكافئة لهذه العناصر هو 7، ولهذا السبب فهي بحاجة لإلكترون واحد للاستقرار.
أما المجموعة التي على يسارها فهي الأكسجينات، وعدد إلكترونات التكافؤ لهذه العناصر هو ست إلكترونات، ولهذا فهي تحتاج إلى إلكترونين للاستقرار.
أما على أٌقصى يسار الجدول الدوري، نجد مجموعة تبدأ بعنصر الهيدروجين، وهذه مجموعة الفلزات القلوية، وعدد إلكترونات التكافؤ فيها هو 1، وهي تميل لخسارة هذا الإلكترون للاستقرار، باستثناء الهيدروجين الذي يُمكنه فقد أو كسب إلكترون للاستقرار.
على يمين الفلزات القلوية مجموعة الفلزات القلوية الأرضية، وعدد إلكترونات التكافؤ فيها هو 2، وهي تميل لخسارتهما للاستقرار.
أنواع الروابط الكيميائية
الرابطة الأيونية
الرابطة الأيونية هي الرابطة التي تُكونها العناصر السالبة أو الموجبة، ويُطلق عليها في هذه الحالة اسم الأيونات الموجبة أو السالبة.
الأيونات السالبة هي الأيونات التي عليها منح الإلكترونات للوصول إلى الاستقرار، أما الأيونات الموجبة فهي الأيونات التي تحتاج إلى الإلكترونات للاستقرار.
على سبيل المثال، تُعد الهالوجينات من الأيونات السالبة، ولهذا لأنها تحتاج لإلكترون واحد فقط للوصول لحالة الاستقرار.
يٌعبر عن عدد الإلكترونات الذي تحتاجه الأيونات السالبة بمصطلح الرقم الأيوني، وهذا يعني أن الرقم الأيوني للهالوجينات هو -1، وعلى سبيل المثال يُكتب أيون الكلور بهذا الشكل:
CL-1
تُشكل مجموعة الهالوجينات مع مجموع الفلزات القلوية متفاعلات ممتازة، وهذا لأن الفلزات القلوية تمنح إلكترون للهالوجينات، وبتفاعلهم معًا يصلان معًا للاستقرار، وهذه هي الرابطة الأيونية.
لهذا السبب دائمًا ما تكون المركبات متعادلة الشحنة، مثل مركب كلوريد الصوديوم أو ملح الطعام، والذي يتألف من تفاعل أيون الصوديوم الموجب مع أيون الكلور السالب.
الرابطة التساهمية
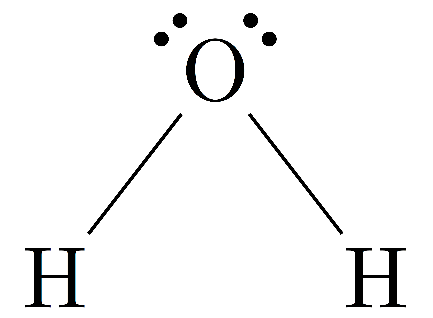
لشرح الرابطة التساهمية بشكل أفضل سنستخدم ذرة الأكسجين كمثال، ووفق ما ذُكر أعلاه فإن أيون الأكسجين السالب يحتاج إلى إلكترونين للاستقرار.
لكن ماذا لو أحضرنا ذرة أكسجين أخرى، وهي الأخرى بحاجة لإلكترونين للاستقرار، فكيف ستتحد ذرتا الأكسجين معًا؟
عدد إلكترونات التكافؤ للأكسجين هو ست إلكترونات، وابتكر العالم لويس طريقة أطلق عليها اسم مخطط لويس النقطي، لرسم هذه الإلكترونات على شكل نقاط حول الذرات، وكان مخطط لويس لأيون الأكسجين كالآتي:
نُلاحظ عند ترتيب النقاط، أن لذرة الأكسجين إلكترونين وحيدين غير مرتبطين بإلكترون آخر، وفي الرابطة التساهمية، يتحد هذان الإلكترونان من ذرة الأكسجين الأولى مع الإلكترونين في ذرة الأكسجين الثانية.
بعد اتحاد الإلكترونين من الذرة الأولى مع الإلكترونين من الذرة الأخرى، يُشكل هذا رابطة ثنائية بين ذرتي الأكسجين، وهذا لأن إلكترون كل ذرة اتحد مع إلكترون الذرة الأخرى، ويُعبر عن هذه الرابطة برسم خط -، وبما أنها رابطة ثنائية فسيُعبر عنها بالشكل الآتي:

وبذلك تمتلك كل ذرة أكسجين ثماني إلكترونات، أربعة ممثلة في الشكل على شكل نقاط، وأربعة أخرى متمثلة على شكل خطين.
من الجدير بالذكر أن هذه الرابطة الثنائية تمنح ذرتا الأكسجين ترابطًا قويًا، ومن المهم قول أن الرابطة الثنائية أقوى من الرابطة الأحادية التي يُعبر عنها بخط واحد.
الرابطة الكهروسالبية
تعني الكهروسالبية مقدار قدرة الذرة على جذب الإلكترونات، وكلما كانت قادرة على جذب إلكترونات أكثر، كانت الكهروسالبية أقوى.
تطرقنا سابقًا للرابطة الكهروسالبية في المقال المتعلق بالماء والحياة، ومن الجدير بالذكر أن الرابطة الكهروسالبية تُعد فرعًا من الرابطة التساهمية.
يُمكن التعبير عن الرابطة الكهروسالبية لتسهيل الفهم على أنها كم قوة تمسك الذرة بالإلكترونات.
على سبيل المثال في جزيء الماء الذي يتألف من أيونا هيدروجين موجبين وأيون أكسجين سالب.

لتسهيل فهم الكهروسالبية، يُعد الأكسجين أكثر حبًا للإلكترون، وهذا يعني أنه يميل للتمسك بالإلكترونات التي حصل عليها أكثر من الهيدروجين.
في جزيء الماء، كلًا من الهيدروجين والأكسجين وصلا للاستقرار، ولكن تُعد قُدرة الأكسجين على التمسك بالإلكترونات أكبر، ولهذا تقضي الإلكترونات خلال حركتها حول النواة فترة أطول حول الأكسجين مقارنة بالهيدروجين، وهذا يعني أنه أكثر كهروسالبية من الهيدروجين.
في الحقيقة تُساهم الكهروسالبية في الكثير من خصائص المياه، وتُعد هذه النقطة أساسية إذا أردنا دراسة الكمياء العضوية.
في الجدول الدوري، يقع الأكسجين في مكان أقرب إلى الغازات النبيلة، ولذلك فهو يتطلع إليها، مما يجعله أكثر كهروسالبية.
مقارنة بالهيدروجين الذي يقع في العمود الأول على يسار الجدول الدوري، فهو بعيد تمامًا عن الغازات النبيلة، ولا يهتم إذا وصل لاستقرارها أم لا بقدر اهتمام الأكسجين.
ستُساعدك هذه الفكرة على إدراك أنه كلما اتجهنا في الجدول الدوري إلى اليمين، كلما زادت الكهروسالبية، والعكس صحيح.
ولكن ماذا عن الأعلى والأسفل؟
كلما اتجهنا في الجدول الدوري إلى الأسفل، امتلكت العناصر عدد إلكترونات أكبر، وهذا يجعلها غير مهتمة باكتسابها، وبهذا فكلمة اتجهنا إلى أسفل في الجدول الدوري تقل الكهروسالبية.
في النهاية، كانت هذه معلومات بسيطة قدر الإمكان عن كيمياء الحياة، ويتبقى الجزء الأخير في كيمياء الحياة في المقال المقبل، والذي سيتطرق لشرح مختصر للتفاعلات الكيميائية وتطبيقاتها الحياتية.