عالم الأحياء 14: شكل البروتين وبنيته
عالم الأحياء 14: شكل البروتين وبنيته
هل تساءلت من قبل لماذا يتحول بياض البيض من اللون الشفاف إلى اللون الأبيض الناصع؟
سأجيب في ها المقال عن هذا السؤال.
يحتوي بياض البيض على نسبة كبيرة من بروتين يُطلق عليه اسم الألبومين أو الزلال، والألبومين في الغالب هو بروتين ثلاثي الأبعاد، وله شكل واضح ومحدد، ويعود السبب في ذلك إلى الروابط القوية التي تربط بين أحماضه الأمينية المختلفة.
عندما يتعرض البيض للحرارة، تبدأ هذه الروابط القوية بالتكسر، وتكتسب بعض الأحماض الأمينية الكارهة للماء خصائصها مجددًا، وبالتالي تبتعد هذه الأحماض الأمينية عن الماء الموجود في بياض البيض، وتلتصق معًا لتُشكل بنية بروتينية جديدة هي بياض البيض الأبيض الذي نراه.
تخيل أن عملية تمسخ البروتين هي التي تنتج عنها تلك الوجبة اللذيذة التي نضعها على مائدة الإفطار؟
ذكرنا في المقال السابق معنى البروتينات والأحماض الأمينية، كما تطرقنا لنقطة أن للبروتينات أشكال مختلفة، وينتج عن ذلك اختلاف وظائفها.
لهذا السبب من المهم للغاية فهم شكل البروتين وكيف يكتسب البروتين شكله، وبالتالي من الضروري للغاية معرفة أن لبنية البروتين أربع مستويات أساسية وهي المستوى الأولي، المستوى الثانوي، المستوى الثالثي والرباعي.
بنية البروتين الأولية
أبسط مستوى من بنية البروتين هو بنية البروتين الأساسية أو الأولية، وهي ببساطة تسلسل الأحماض الأمينية في سلسلة عديد الببتيد.
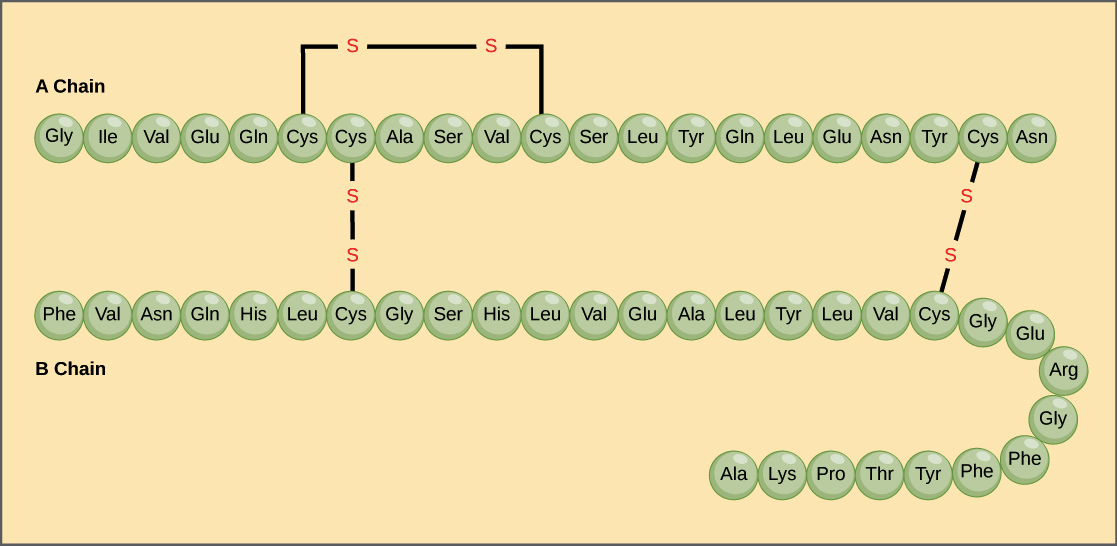
من أبرز الأمثلة على بنية البروتين الأساسية هرمون الأنسولين، والذي يتألف من سلسلتين، يُرمز للسلسلة الأولى بالسلسلة A، والتي تبدأ بالجلايسين من الاتجاه N وتنتهي بالأسباراجين بالاتجاه C.
أما السلسلة الثانية فيرمز لها بالسلسلة B، وتتألف من ترتيب مختلف من الأحماض الأمينية.
في الشكل الآتي رسم توضيحي لأنسولين الأبقار، وهو يُشبه أنسولين البشر بشكل كبير، ويُمكننا ملاحظة كيفية ترتيب السلسلتين معًا.
مصدر الصورة: OpenStax Biology
يتم تحديد الأحماض الأمينية التي تتألف منها كل سلسلة من البروتين بواسطة الجينات التي تترتب معًا في الحمض النووي، وهذه الجينات تتألف من شيفرة معينة يُترجمها الجسم إلى البروتين عندما يُعاني من نقص فيه أو عندما يحتاج له.
لهذا السبب أي تغيير بسيط ولو في جين واحد في تسلسل الحمض النووي يُمكن أن يُغير من تركيبة البروتين بأكمله وبالتالي يؤثر أيضًا على وظيفته.
على سبيل المثال، يحدث مرض فقر الدم المنجلي نتيجة تغيير بسيط للغاية في إحدى السلاسل المكونة للهيموجلوبين، وهو البروتين المسؤول عن نقل الأكسجين من وإلى الخلايا.
يحدث هذا التغير البسيط عندما يتم استبدال الحمض الأميني السادس حمض الغلوتاميك بحمض آخر يُطلق عليه اسم حمض الفالين في سلسلة الهيموجلوبين.
نتيجة لذلك يتغير شكل خلايا الدم الحمراء ويُقارب شكلها المنجل، ولهذا السبب يُطلق على هذا المرض اسم فقر الدم المنجلي، وهو من الأمراض الوراثية.
من الجدير بالذكر أن بروتين الهيموجلوبين يتألف من سلسلتين من الأحماض الأمينية، يُطلق على السلسلة الأولى اسم سلسلة ألفا والسلسلة الثانية هي سلسلة بيتا.
تتكون كل سلسلة في الهيموجلوبين من 150 حمض أميني، والفرق بين عدد الأحماض الأمينية في الهيموجلوبين الصحي والهيموجلوبين في فقر الدم المنجلي هو حمضان أمينيان فقط.
في فقر الدم المنجلي، يُغير الفالين من شكل بروتين الهيموجلوبين ويُحوله إلى ألياف طولية، وهي السبب في تشوه شكل خلية الدم الحمراء.
يُظهر الرسم أدناه بعض خلايا الدم الطبيعية ومن بينها بعض الخلايا منجلية الشكل أو هلالية الشكل والتي تدل على الإصابة بفقر الدم المنجلي.
تتضمن أعراض فقر الدم المنجلي ضيق النفس، الدوار، الصداع وآلام البطن، ويُمكن أن تتطور هذه الأعراض تطورات خطيرة للغاية، وهذا لأن شكل الخلايا المنجلي يتسبب في إعاقة حركة الخلايا بسلاسة في الدورة الدموية.
بنية البروتين الثانوية
المستوى الثاني من بنية البروتين هو الهيكل الثانوي أو بنية البروتين الثانوية، وهي أشكال مطوية في داخل السلاسل عديدة الببتيد، والناتجة عن التفاعلات بين ذرات الهيكل الرئيسي للبروتين.
يُقصد بالهيكل الرئيسي للبروتين السلسلة عديدة الببتيد بغض النظر عن محتوى المجموعة المتغيرة في الأحماض الأمينية التي يتألف منها عديد الببتيد.
أشهر أنواع بنية البروتين الثانوية تتضمن الألفا الحلقي وصفيحة البيتا، وتتماسك الوحدات الرئيسية في كل شكل من هذه الأشكال من خلال رابطة هيدروجينية.
يوضح الشكل أدناه كيفية ترتيب الأحماض الأمينية بحسب نوع بنية البروتين الثانوية، سواء كان صفيحة بيتا أو ألفا حلقي.
في الألفا الحلقي، ترتبط مجموعة الكربونيل -وهي مجموعة الكربون التي ترتبط برابطة ثنائية مع الأكسجين- برابطة هيدروجينية مع مجموعة الأمين من الحمض الأميني الي يليها.
يُؤدي هذا التفاعل إلى ارتباط الأحماض الأمينية معًا بطريقة حلزونية أو حلقية، ويُمكن أن يتألف الانحناء الواحد من 3.6 من الأحماض الأمينية.
أما النوع الثاني صفيحة بيتا فهو يُشبه أكثر الصفيحة المطوية، ويتشكل هذا الشكل باتحاد السلاسل عديدة الببتيد معًا بطريقة أفقية، وقد تكون كل سلسلة موازية أو غير موازية للسلسلة الأخرى.
تميل بعض أنواع الأحماض الأمينية إلى الشكل الحلزوني، بينما تميل الأنواع الأخرى إلى شكل الصفيحة المطوية.
على سبيل المثال يميل البرولين إلى الشكل الحلزوني أو الحلقي، بينما يميل التربتوفان والتيروزين إلى شكل الصفيحة المطوية.
تتألف بعض البروتينات من أحد النوعين، بينما يتألف البعض الآخر من اندماج الألفا الحلقي مع صفيحة بيتا، بالإضافة إلى بعض أنواع البروتينات التي لا تتضمن كلا النوعين.
المستوى الثالثي
المستوى الثالث أو بنية البروتين الثالثة هي ترتيب ثلاثي الأبعاد للبروتين، والمجموعة المتغيرة في الأحماض الأمينية هي من أبرز العوامل المؤثرة في المستوى الثالثي.
المجموعة المتغيرة كما ذكرنا سابقًا في المقال السابق من هذه السلسلة أنها هي التي تمنح البروتين مجموعة من الخصائص مثل القطبية المحبة للماء أو الغير قطبية والكارهة للماء.
من العوامل المؤثرة أيضًا على المستوى الثالثي نوع الروابط الكيميائية بين الأحماض الأمينية، حيث يُمكن أن تكون روابط هيدروجينية، تساهمية، أيونية أو قطبية، ومن الجدير بالذكر أن هذا أيضًا يعتمد على المجموعة المتغيرة في الحمض الأميني.
من أنواع الروابط التساهمية المؤثرة في المستوى الثالثي رابطة ثاني الكبريتيد، ويُرمز لها أحيانًا بالرابطة -SS، والتي تعد من أقوى أنواع الروابط التساهمية.
المستوى الرباعي
غالبًا ما تتألف البروتينات سلسلة عديدة الببتيد واحدة فقط ولها ثلاثة مستويات وهي المستويات التي ذكرناها أعلاه.
في المقابل، يُمكن أن تتضمن بعض البروتينات مجموعة من السلاسل الفرعية عديدة الببتيد والتي تتحد معًا لتُنتج المستوى الرباعي.
في الحقيقة، لقد ذكرنا أعلاه الهيموجلوبين، يمتلك بروتين الهيموجلوبين مستوى رباعي، ويتكون من أربع سلاسل فرعية، سلسلتان من ألفا وسلسلتان من بيتا يتحدان معًا.
مثال آخر على المستوى الرباعي إنزيم البلمرة المتسلسل والذي يتألف من عشر وحدات فرعية.
تمسخ وطي البروتين
لكل بروتين شكله وقوامه المميز، ولكن إذا تعرض البروتين لدرجة حرارة غير طبيعية بالنسبة له أو درجة حموضة مختلفة فهذا يؤدي إلى تمسخ البروتين.
في هذه الحالة يفقد البروتين بنيته الثلاثية، وهذا ما يجعل البروتين عبارة عن مسخ.
يُمكن عكس تمسخ بعض البروتينات وخصوصًا إذا لم تتكسر الأحماض الأمينية.
وهذا يعني احتمالية إعادة تكونها من جديد، ولكن في بعض الأحيان يكون تمسخ البروتين دائمًا.
من أبرز الأمثلة على تمسخ البروتين الدائم سلق البيض، حيث يتغير لونه ولا يمكن استعادته مجددًا.
