ما هي طريقة هابر بوش
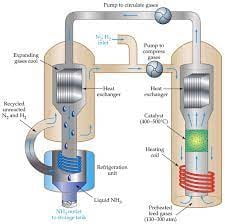
إن طريقة هابر بوش هي عبارة عن طريقة لتصنيع الأمونيا، حيث يتم تصنيعها بشكل مباشر من النيتروجين والهيدروجين عبر آلية معينة.
تم تطوير هذه الطريقة من قبل العالم الألماني فريتز هابر وحصل إثرها على جائزة نوبل للكيمياء في عام 1918 وأصبح بعدها قادر على تصنيع الأمونيا بشكل تجاري.
فيما بعد قام أكمل العالم كارل بوش ما بدأه فريتز هابر وصنع الأمونيا على نطاق أكبر وأوسع باستخدام عامل محفز وضغط عال، وعلى إثر ذلك حصل على جائزة نوبل للكيمياء عام 1930 مع العالم فريدريك بيرجوس.
سنتحدث في هذا المقال عن طريقة هابر بوش وتاريخها.
تعريف هابر بوش
إنها طريقة تعتبر من أوائل الطرق الصناعية التي استخدم فيها الضغط العالي جدًا لإجراء التفاعلات الكيميائية المختلفة.
تم توفير جو مثالي لتفاعل الهيدروجين مع النيتروجين بشكل مباشر تحت ضغط عالي ودرجة حرارة عالية وفق التفاعل التالي:
N2 + 3H2 ⇋ 2NH3
فيما بعد تم تطوير التفاعل واستخدام الحديد كعامل محفز مع وجود درجة حرارة منخفضة نسبيًا ولكن يمكن التعامل معها بشكل عملي.
إن استخدام درجة حرارة منخفضة وضغط جوي عالي ساعد في إزاحة موضع التفاعل وتكوين الأمونيا بكميات كبيرة وبالتالي أصبح بالإمكان توزيعها تجاريًا.
يمكن القول أن التفاعل التجاري يجرى عند ضغط يتراوح ما بين 200 إلى 400 ضغط جوي مع درجة حرارة تتراوح ما بين ال750 إلى 1200 درجة سيليزية.
تاريخ عملية هابر بوش
إن عملية هابر بوش الأصلية الأولى تم تطويرها من قبل العالم فريتز هابر وعدلت بعدها من قبل كارل بوش لتصبح عبارة عن عملية لتصنيع الأسمدة التي تسمى بهابر بوش.
قبل أن تتطور العملية وتأخذ شكلها الجديد في القرن التاسع عشر كان هناك حاجة متزايدة في العالم لتصنيع المزيد من الحبوب بسبب النمو السكاني الضخم مما ساهم في ظهور مناطق زراعية جديدة في روسيا والأمريكيتين.
نتيجة لذلك بدأ العديد من الكيميائيين في أواخر القرن التاسع عشر في البحث عن طرق جديدة لإنتاج السماد بواسطة التثبيت الاصطناعي للنيتروجين، وهي نفسها الآلية التي تحدث في جذور البقوليات بشكل طبيعي.
على الرغم من أن غاز النيتروجين كان موجود في الجو بشكل طبيعي إلا أنه كان هناك حاجة لإيجاد طريقة تجعله قابل للاستخدام في هذه العمليات.
هنا ظهر دور العالم فريتز هابر حيث سعى بشكل جدي لتلبية احتياجات ألمانيا من كل المواد الكيميائية التي تلزمها خلال الحرب العالمية الأولى، وفي 2 يوليو عام 1909 استطاع أن يثبت الهيدروجين على شكل مركب قابل للذوبان في الماء وهو الأمونيا حاليًا.
فعل ذلك عن طريق إمرار غازات النيتروجين والهيدروجين ضمن أنبوب حديدي مضغوط وساخن وأضاف محفز هو فلز الأوزميوم وهكذا كانت المرة الأولى التي يتم فيها إنتاج الأمونيا بشكل حقيقي ضمن معمل.
اقرأ أيضًا: عالم الأحياء 4: العناصر والذرات
من هو فريتز هابر
إن فريتز هابر هو العالم الذي ننسب إليه عملية هابر بوش الأولى بالكامل، وهو من مواليد 9 ديسمبر عام 1868 في ألمانيا وتحديدًا في بريسلاو، وتوفي بعدها في 29 يناير عام 1934.
اهتم هابر بدراسة علم الكيمياء منذ طفولته وتحديدًا بربط العديد من العمليات الكيميائية بعمليات التصنيع لذلك كان له أبحاث عديدة في مجال الاختزال والأكسدة الإلكتروليتية.
نشر فيما بعد كتاب شرح فيه عن عملية اختزال النيتروبنزين على عدة مراحل عند الكاثود وقد اعتبر نموذجًا لعمليات الاختزال الأخرى حتى حصل على جائزة نوبل على طريقة هابر بوش لإنتاج الأمونيا في عام 1918.
كان أيضًا أول عالم اقترح إمكانية استخدام غاز الكلور كسلاح في الحروب وبالفعل استخدمته ألمانيا في الحرب العالمية الأولى ضد فرنسا.
في تلك الفترة كانت الأمونيا تستخدم في تصنيع المتفجرات مما دفع العديد من الناس إلى توجيه الكثير من الانتقادات اللاذعة التي نبذ على أساسها من ألمانيا، على الرغم من وجود دور كبير لعملية تثبيت الهيدروجين في تطوير الزراعة بعد انتهاء الحروب ولكن تم تجاهل هذا الأمر تمامًا وسافر بعدها إلى إنجلترا.
تفاصيل طريقة هابر بوش لتحضير الأمونيا
كما ذكرنا سابقًا تعتمد هذه الطريقة بشكل أساسي على خلط النيتروجين مع الهيدروجين بنسب حجمية هي (1:3) مع وجود عامل محفز وتحت ضغط كبير يساعد على سحب السائل المتكون باستمرار أولًا بأول .
كان هذا التفاعل العكسي مهم جدًا من الناحية الصناعية حيث تم الاستفادة منه في تصنيع غاز الأمونيا وبعدها تحويله إلى حمض النيتريك (HNO3) وفيما بعد إلى نترات الأمونيوم (NH4NO3) التي يكثر استعمالها في تصنيع الكثير من المفرقعات الخطيرة وأيضًا مخصبات الأراضي الزراعية.
إذا يتفاعل غاز الهيدروجين (H2) مع غاز النيتروجين (N2) في ظروف ملائمة ومناسبة بهدف تكوين غاز النشادر وهو ما يسمى بالتفاعل الأمامي Forward Reaction.
لكن نلاحظ أنه عند ظروف التفاعل نفسها سنجد أن غاز النشادر المتشكل لدينا سيكون له القدرة على التفكك بسهولة ليعطي المواد المتفاعلة مجددا وهي الهيدروجين والنيتروجين مرة أخرى وهو ما يعرف باتجاه التفاعل الخلفي Backward Reaction ويمكن تسميته بالاتجاه الانعكاسي أو العكسي أيضًا.
نكتب المعادلة الكلية للتفاعل الحاصل بين غازي الهيدروجين والنيتروجين كما يلي:
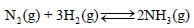
ظروف التفاعل التي يحتاجها التفاعل هي كما يلي:
- الضغط الموجود في جو التجربة هو (100 – 1000) جو.
- درجة الحرارة الملائمة هي 400 – 500 درجة مئوية.
- يجب أن يتواجد عامل محفز هو مسحوق الحديد الناعم الذي يحتوي على القليل من الأكاسيد لكي يوسع السطح البيني الخاص بالتفاعل.
خواص غاز النشادر
- الأمونيا هي عبارة عن غاز عديم اللون وحاد وأخف من الهواء.
- يغلي غاز الأمونيا في درجة حرارة هي 33.35 مo ويتجمد عند درجة هي 778 مo .
- يسال غاز النشادر في الضغط والتبريد أيضًا.
- إن وجود شكل روابط هيدروجينية في سائل الأمونيا يجعله ممتلك لبعض الخواص الفيزيائية الشبيهة بالماء من حيث قابلية التشكل الهرمي والفعالية العالية.
- يمتلك عزل كهربائي عالي نسبيًا مما يجعله مذيب مؤين مقبول.
- يذيب الكثير من أنواع الفلزات مثل الفلزات القلوية والترابية.
